はじめに/Introduction
私たちは、正常な遺伝子発現には無くてはならないメカニズムであるmRNAスプライシングの研究をしています。私たちの身体を構成している細胞中ではDNAに遺伝情報が書き込まれており、この遺伝情報がRNAへと転写され、さらにそのRNAの情報をリボソームが読み解くことで、細胞内において機能するタンパク質を合成しています。ヒトなどの真核生物においては、この転写された直後のmRNAは未成熟な状態であり、mRNAスプライシングなどの転写後修飾を受けることによって、タンパク質合成の鋳型となります。したがって、mRNAスプライシングは細胞が持つ遺伝情報を読み解くために必要不可欠な機構であり、mRNAスプライシングの異常により様々な疾患が引き起こされていることも知られています。
そこで私たちは、mRNAスプライシングメカニズムの詳細な解析を行なうことにより、真核生物における巧妙な遺伝子発現制御機構を明らかにし、スプライシング異常が引き起こす様々な疾患の原因究明、治療法の開発に貢献したいと考えています。
We are studying on mRNA splicing mechanism, one of the most critical steps for proper gene expression. Human body consists of approximately 60 trillion cells containing DNA that carries genetic information. As the first step of gene expression, DNA is transcribed into RNA and ribosome translates genetic information from the RNA to protein. In eukaryote, newly transcribed mRNA is premature and should be processed by post-transcriptional modification machineries including splicing to become mature mRNA. Therefore, mRNA splicing is a prerequisite mechanism for gene expression and it is well known that mRNA splicing deficiency causes numerous diseases. Currently, we are interested in understanding gene expression mechanism in eukaryotic cells and contributing development of therapy for splicing related diseases through studying on mRNA splicing machinery.
1) スプライシングと転写/Relationship between splicing and transcription
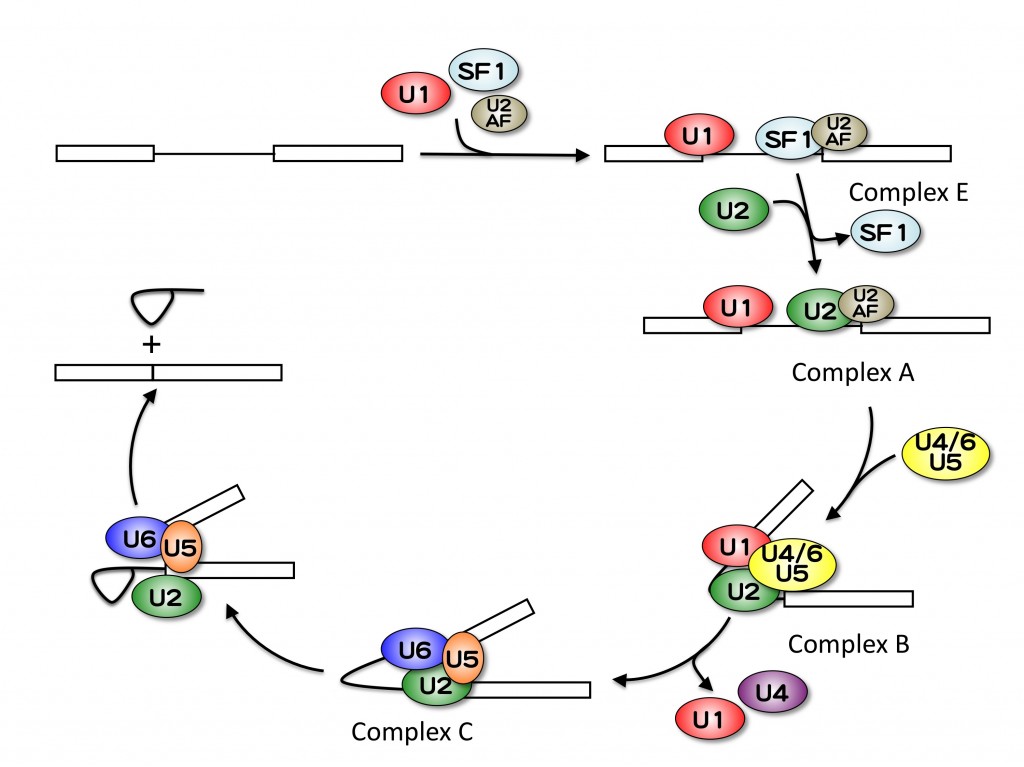
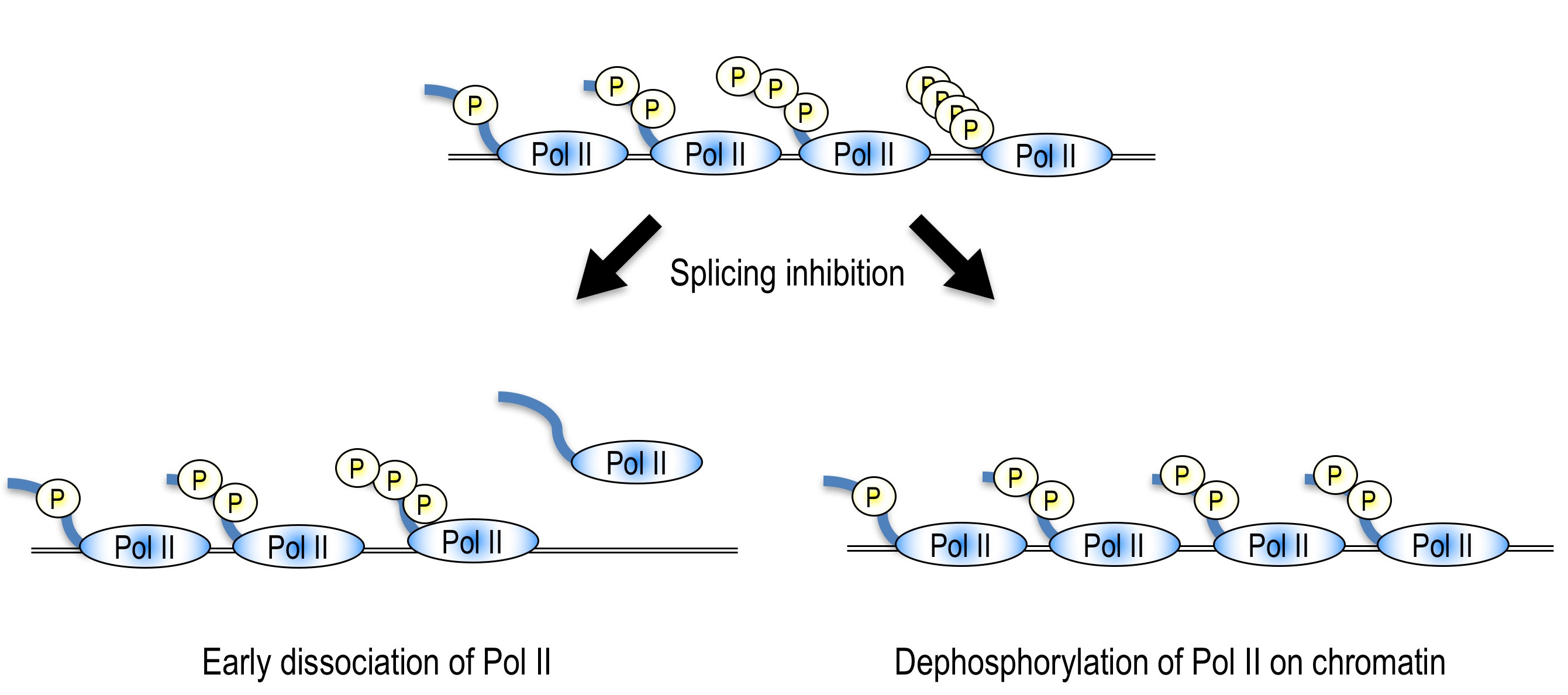
mRNAスプライシングをはじめとした転写後修飾は、転写とカップリングする事によってその効率が高まることはよく知られていますが、逆に転写後修飾が転写に与える影響についてはあまり知見がありません。そこで、スプライシングが転写に与える影響を調べるために、スプライシング阻害剤であるスプライソスタチンAやスプライソソームのコンポーネントに対するアンチセンスオリゴを用いてスプライシングを阻害し、遺伝子発現の変化を観察したところ、多くの遺伝子において遺伝子の3’末端の発現が低下することが明らかとなりました。また、3’末端の発現が低下する遺伝子においては、遺伝子の5’末端においてRNAポリメラーゼIIの蓄積が観察されました。これらのことから、スプライソソームの阻害により、おそらく転写の伸長が抑えられ、その結果遺伝子3’末端の発現が低下すると考えています。
さらに、スプライシング異常が転写に与える影響を観察したところ、スプライシング阻害時にはmRNAの転写を行うRNAポリメラーゼIIのC末端部位のリン酸化が低下していることが明らかとなりました。スプライシングは、真核生物の遺伝子発現に必須な機構の一つですが、他の遺伝子発現機構(すなわち転写や翻訳)を阻害しても、同様のリン酸化レベルの低下は観察されませんでした。したがって、この現象はmRNAスプライシングの阻害特異的な現象であると言えます。さらに、その原因を探索したところ、一つの原因は上述した転写伸長の抑制であり、また、未知のメカニズムによってもリン酸化レベルの低下が引き起こされていることが明らかとなりました。今後は、この未知のメカニズムについて研究を進めていく予定です。
We are interested in the effect of splicing inhibition/abnormality on transcriptional activity. We observed gene-specific 3’-end down-regulation after splicing inhibition. We also revealed that splicing inhibition causes accumulation of Pol II near the 5’ end of genes. These results suggest that splicing inhibition leads to transcription elongation defect in a gene specific manner. We speculate that splicing activity is important for production of full length mRNA through regulation of transcription elongation. This might function as a novel checkpoint mechanism to prevent pre-mRNA accumulation and translation which leads to production of aberrant proteins (Koga et al., 2014).
We also found that splicing inhibition decreases phosphorylation level of Ser2 in C-terminal domain of Pol II, which is important for transcription elongation, but not transcription inhibition and translation inhibition. Therefore, the dephosphorylation of Ser2 is a splicing inhibition specific phenomenon. We also revealed that transcription elongation defect causes the dephosphorylation of Ser2, in addition to an unknown mechanism. We will investigate the detailed molecular mechanism of transcription elongation defect and dephosphorylation of Ser2 after splicing inhibition in the future study (Koga et al., 2015).
2) スプライシングと細胞周期/Relationship between splicing and cell cycle progression
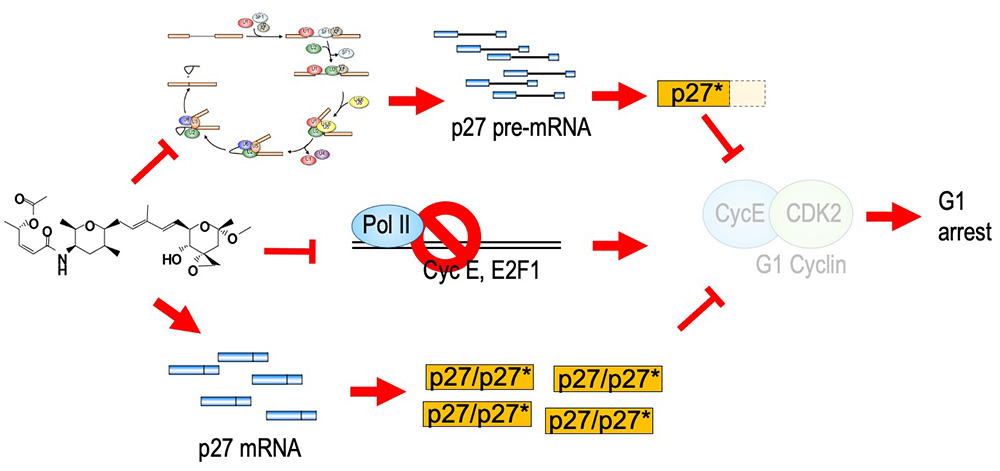
スプライシング阻害剤であるスプライソスタチンAは、非常に強い抗がん活性を持ち、また、細胞周期をG1期並びにG2/M期で停止させることが知られていました。しかしながら、その詳細な分子機構はわかっていませんでした。そこで、G1期における細胞周期停止メカニズムの解析を行ったところ、G1期における細胞周期進行に非常に重要な役割を果たすCDKインヒビターp27の発現が上昇しており、また、p27より若干分子量の小さいトランケート型p27 (p27*)が産生されていることが明らかとなりました。このp27*はスプライソスタチンA処理により蓄積したpre-mRNAが翻訳されたものです。次に、p27やp27*がスプライソスタチンA処理によるG1期停止に関わるかどうかを明らかにするため、p27やp27*を細胞で過剰発現させたところ、細胞周期がG1期で停止しました。逆に、p27をsiRNAを用いてノックダウンすることによりスプライソスタチンA処理によるG1期における細胞周期停止が解除されました。以上のことから、p27の発現上昇と、p27*の産生はスプライソスタチンA処理によるG1期停止の原因の一つであると考えられます。加えて、スプライソスタチンA処理細胞では、Cyclin E1やE2F1などといったG1期からS期への移行に必須な遺伝子の発現も低下しており、この遺伝子発現の低下もG1期停止の原因の一つであると考えられます。さらに、私たちはp27タンパク質をコードするCDKN1B mRNAが安定化していることも見出しました。この安定化にはCDKN1B mRNAの3′ UTRが関わっており、さらなるメカニズムの解明を行っています。
A potent splicing inhibitor, spliceostatin A (SSA) also has a potent anti-cancer activity and causes cell cycle arrest at G1 and G2/M phases. However, the molecular mechanism of the cell cycle arrest remained unclear. We revealed that overexpression of the CDK inhibitor p27 and production of a truncated form of p27 (p27*) are the reasons of the G1 arrest after SSA treatment (Kaida et al., 2007; Satoh and Kaida, 2016). In addition, we found that downregulation of CCNE1 and E2F1 genes, which are indispensable for G1-S transition. This downregregulation is also contribute to the G1 arrest caused by splicing inhibition (Kikuchi and Kaida, 2021). Furthermore, we revealed that SSA treatment stabilized CDKN1B mRNA, resulting in p27 upregulation (Kaida and Shida, 2022). This stabilization is caused through 3′ UTR of CDKN1B mRNA. We are investigating detailed molecular mechanisms of the stabilization.
3) スプライシングと脂肪細胞分化/Relationship between splicing and adipogenesis
脂肪細胞分化は非常に複雑な転写因子カスケードにより制御されていることが知られていますが、スプライシングが脂肪細胞分化に与える影響に関しては報告がありませんでした。そこで、3T3-L1細胞を脂肪細胞へと分化させる段階でスプライソスタチンA処理を行ったところ、顕著な脂肪細胞分化阻害が観察されました。また、脂肪細胞分化の初期の2日間のみでスプライソスタチンA処理を行った細胞では、全期間スプライソスタチンA処理した細胞と同程度の分化阻害が観察されました。したがって、分化のごく初期段階においてスプライシング機能が重要であると言えます。分化の初期段階には、コンフルエントとなり細胞周期を停止した3T3-L1細胞が細胞周期を再開するMitotic Clonal Expansionと呼ばれる現象が起こることが知られています。そこで、スプライシング阻害が、Mitotic Clonal Expansionを阻害するかどうかを確かめたところ、予想通りMitotic Clonal Expansionを阻害していました。Mitotic Clonal Expansionは、脂肪細胞の分化に必須であることから、スプライシング阻害によりMitotic Clonal Expansionが阻害された結果、脂肪細胞文化が抑制されていると考えられます。今後は、Mitotic Clonal Expansionが阻害されるメカニズムに関して研究を進めていく予定です。